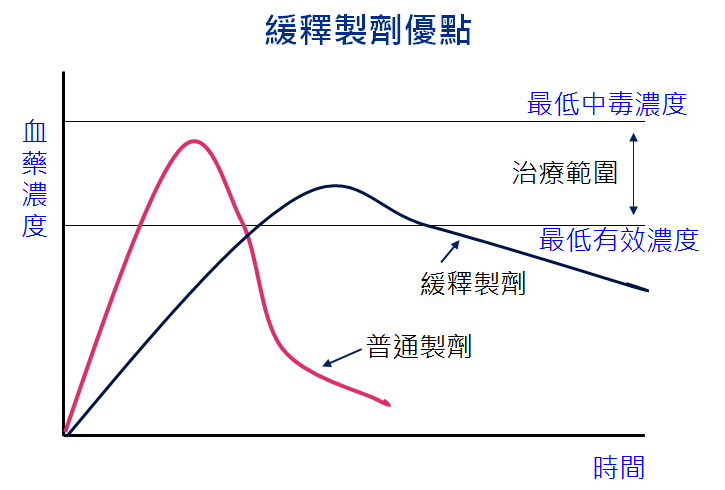
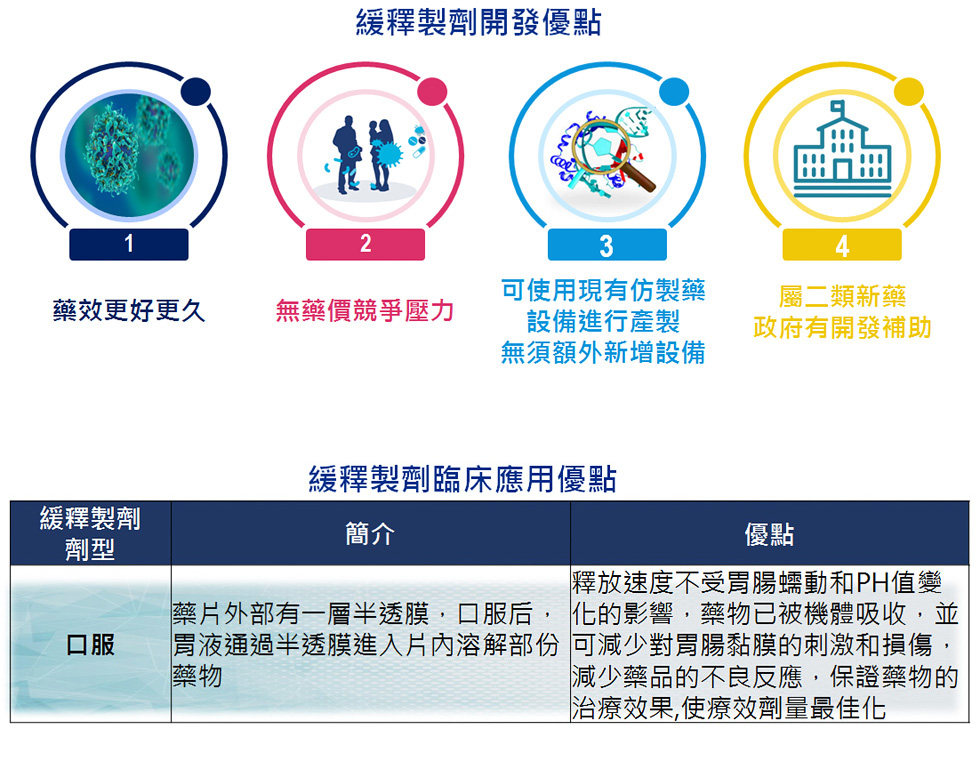
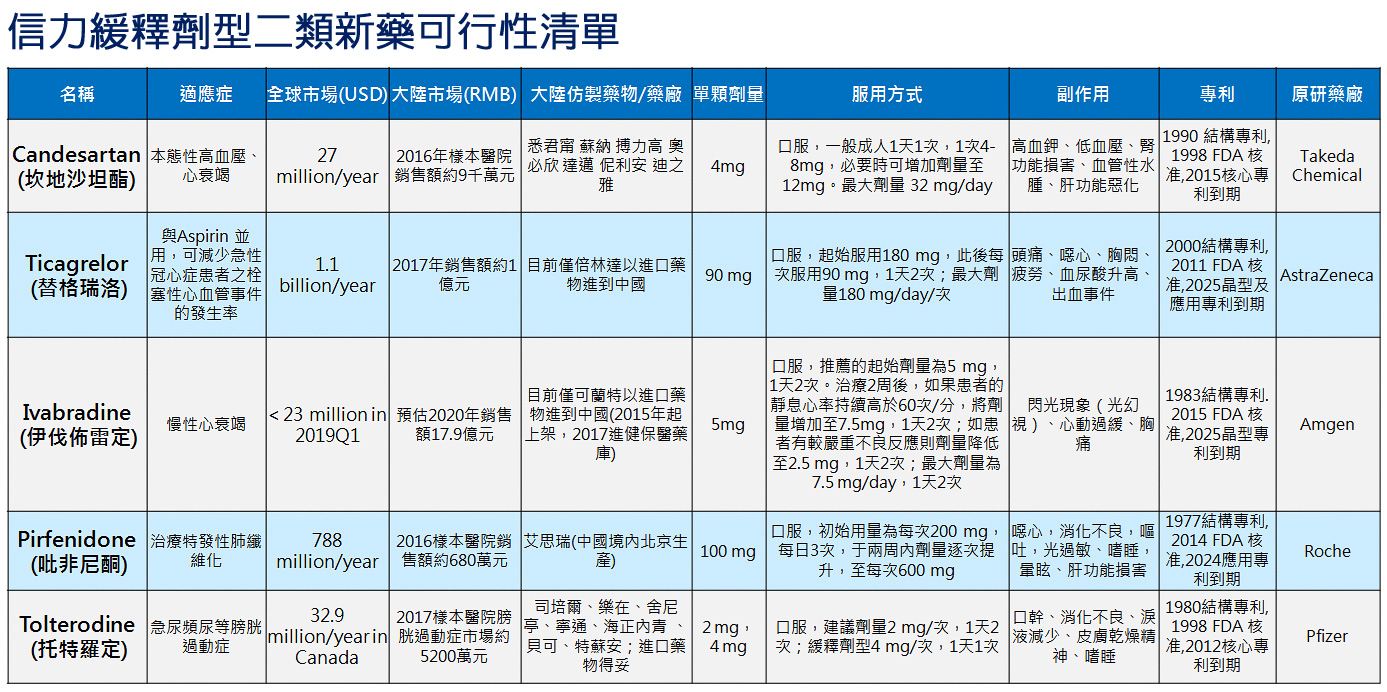
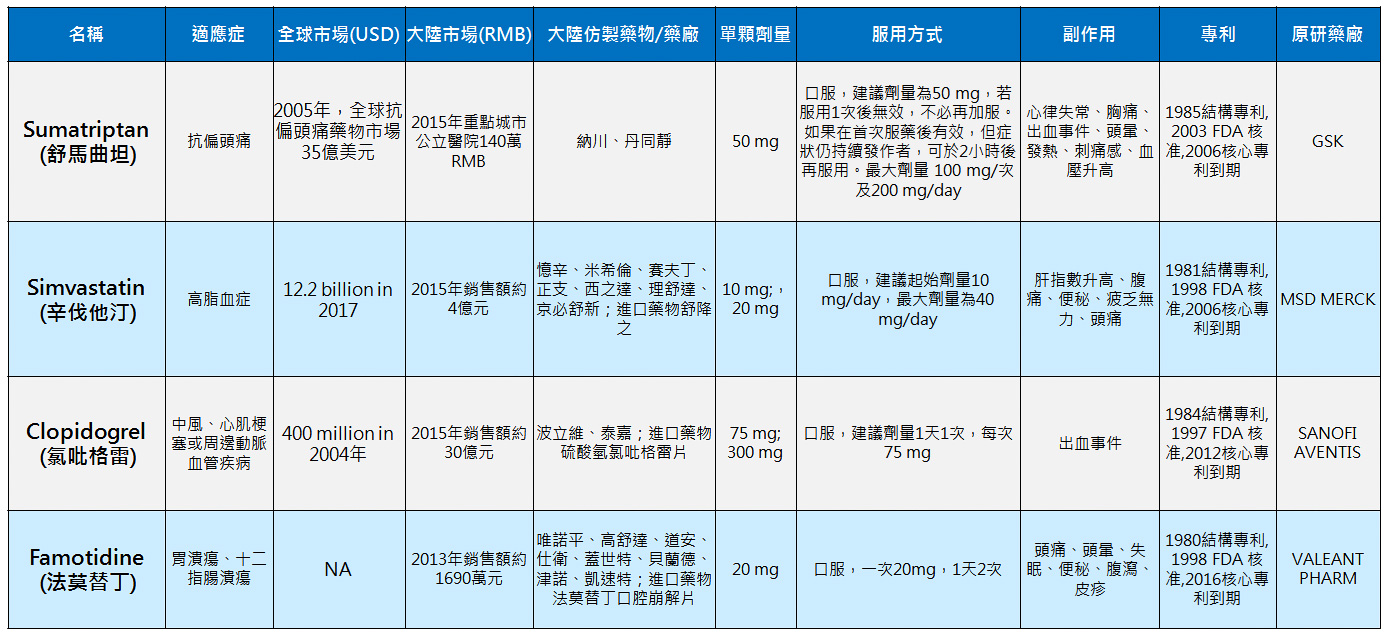
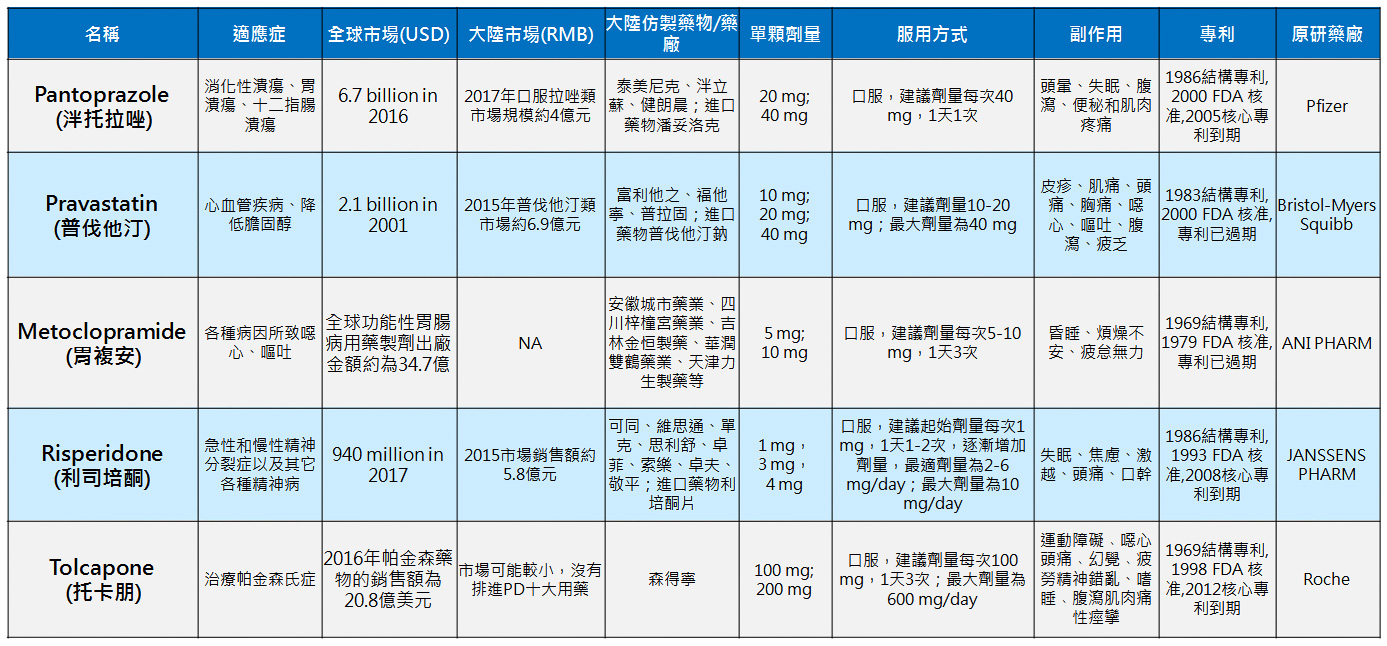
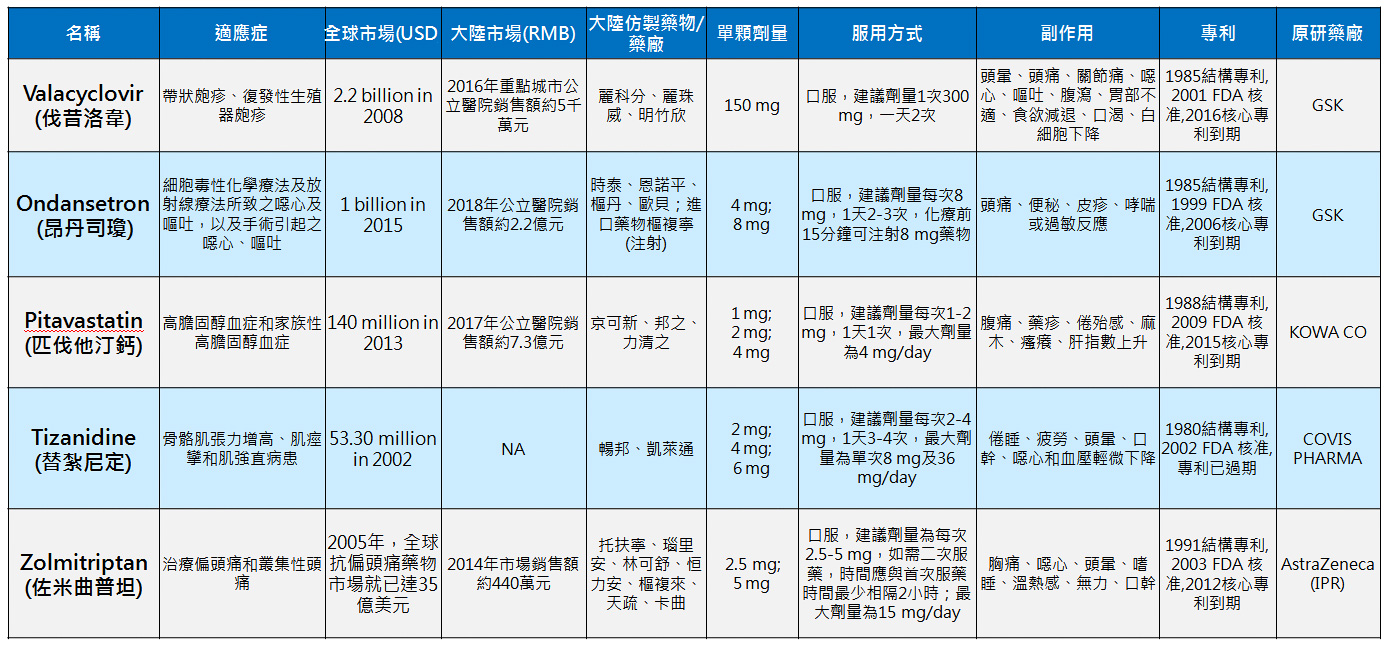
產品與研發PRODUCTS & RD
中國二類新藥505(b)2
2016年CFDA發布的《化學藥品註冊分類改革工作方案》對當前化學藥品註冊分類進行改革,定義二類新藥(改良型新藥)為:境內外均未上市的改良型新藥。指在已知活性成分的基礎上,對其結構、劑型、處方工藝、給藥途徑、適應症等進行優化,且具有明顯臨床優勢的藥品。可再細分五大類:
- 2.1 類 - 改酸根/鹼基
- 2.2 類 - 改劑型、給藥途徑
- 2.3 類 - 新複方製劑
- 2.4 類 - 新適應症
- 2.5 類 - 新用法、新用量
提出原廠藥品資訊及優效性證據後,不需填寫化學藥品IND申請 (臨床 I、II期)。
中國二類新藥的發展類似美國505(b)(2)新藥發展途徑。1984年美國國會通過 Hatch-Waxman Amendment法案後,帶動美國改良型新藥市場的蓬勃成長,循此法案申請獲批的產品數量不斷攀升,在2018年獲准上市的新藥中就有49%為改良型新藥,是新藥領域真正的主流之一。
中國已進入高齡化社會,展現龐大的慢性病藥物商機、現有藥物不良反應率高,加上政策鼓勵醫藥的創新研發,在既有的客戶群基礎上,信力生技擁有特殊開發及製程技術平台的優勢,進一步跨足二類新藥-緩釋製劑市場。